TINCIÓN DE ESPORAS Y CÁPSULAS BACTERIANAS
Algunas bacterias producen una capa externa viscosa extracelular llamada cápsula (3, 5). Las cápsulas son estructuras protectoras con varias funciones, que incluyen, entre otras, la adherencia a superficies y otras bacterias, protección contra la desecación y protección contra la fagocitosis. Las cápsulas se componen típicamente de polisacáridos que contienen más del 95% de agua, pero algunas pueden contener polialcoholes y poliaminas (5). Debido a su composición mayoritariamente no iónica y su tendencia a repeler las manchas, los métodos de tinción simples no funcionan con la cápsula; en cambio, la tinción de la cápsula utiliza una técnica de tinción negativa que tiñe las células y el fondo, dejando la cápsula como un halo transparente alrededor de las células (1, 3) (Figura 4). La tinción de la cápsula implica untar una muestra bacteriana en una tinción ácida en un portaobjetos de microscopio. A diferencia de la tinción de Gram, el frotis bacteriano no se fija con calor durante una tinción de cápsula. La fijación por calor puede romper o deshidratar la cápsula, dando lugar a falsos negativos (5). Además, la fijación por calor puede encoger las células dando como resultado un aclaramiento alrededor de la célula que puede confundirse con una cápsula, dando lugar a falsos positivos (3). La mancha ácida colorea el fondo de la diapositiva; mientras sigue con una tinción básica, Violeta Cristal, colorea las células bacterianas, dejando la cápsula sin teñir y apareciendo como un halo claro entre las células y el fondo del portaobjetos (Figura 5). Tradicionalmente, la tinta china se ha utilizado como tinte ácido porque estas partículas no pueden penetrar la cápsula. Por lo tanto, ni la cápsula ni la celda se tiñen con tinta china; en cambio, el fondo está manchado. Se puede usar rojo Congo, nigrosina o eosina en lugar de tinta china. La tinción de cápsulas puede ayudar a los médicos a diagnosticar infecciones bacterianas al observar cultivos de muestras de pacientes y guiar el tratamiento adecuado del paciente. Las enfermedades comunes causadas por bacterias encapsuladas incluyen neumonía, meningitis y salmonelosis.
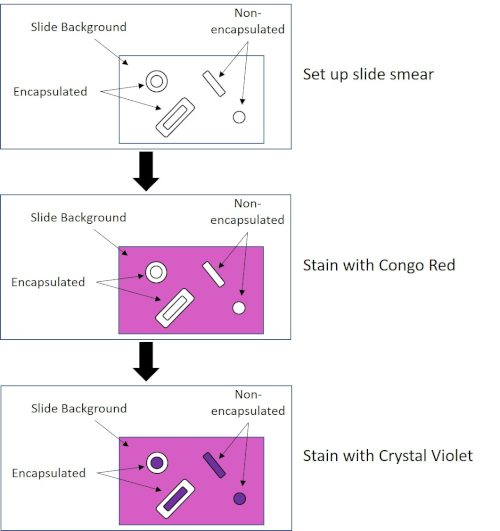
Figura 4: Esquema del protocolo de tinción de cápsulas. El panel superior muestra el frotis del portaobjetos antes de cualquier aplicación de tinte. El panel del medio muestra cómo se ven el portaobjetos y las bacterias después de la tinción principal, Rojo Congo. El panel final muestra cómo se ven el portaobjetos y las bacterias después de la contratinción, Crystal Violet.
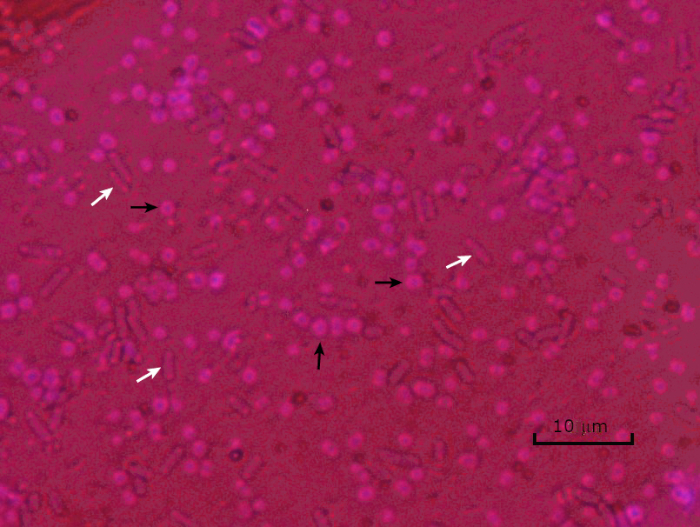
Figura 5: Resultados de tinción de cápsulas. Tinción de la cápsula de Acinetobacter baumannii encapsulado (indicado con flechas negras) y Escherichia coli no encapsulado (indicado con flechas blancas). Observe que el fondo es oscuro y las células de A. baumannii están teñidas de púrpura. La cápsula alrededor de las células de A. baumannii es evidente como un halo, mientras que E. coli no tiene halo.
2. Tinción de cápsulas
- Preparar
- Use guantes y una bata de laboratorio ya que los tintes manchan las manos y la ropa.
- Para preparar una solución de Crystal Violet al 1%, mezcle 0,25 gramos de Crystal Violet con 25 ml de agua destilada hasta que se disuelva.
- Para preparar una solución de rojo Congo al 1%, mezcle 0,25 gramos de rojo Congo con 25 ml de agua destilada hasta que se disuelva.
- Limpie los portaobjetos con toallitas de laboratorio.
- Protocolo
- Coloque 10 µL de rojo Congo en el portaobjetos.
- Con una punta de pipeta, unte una colonia de bacterias en el tinte para producir una capa delgada y uniforme.
- Seque el portaobjetos completamente al aire con la mezcla de tinte / célula, 5-7 minutos.
Nota: No lo fije con calor, ya que el calentamiento puede deshidratar o deformar la cápsula. - Inunde el frotis con Crystal Violet al 1% durante 1 minuto.
- Enjuague el exceso de tinte sosteniendo el portaobjetos en un ángulo y rociando un chorro suave e indirecto de agua sobre el portaobjetos y dejándolo correr sobre las bacterias teñidas. No vierta agua directamente sobre las bacterias.
- Sostenga el portaobjetos en un ángulo de 45 grados hasta que esté completamente seco al aire.
- Examine el frotis en el microscopio bajo inmersión en aceite con un objetivo de 100X.
- Resultados y análisis de datos
- Las células bacterianas se tiñerán de color púrpura.
- El fondo de la diapositiva se teñirá de oscuro.
- Las cápsulas tendrán un halo claro alrededor de las células sobre un fondo oscuro.
ESPORAS BACTERIANAS
En condiciones adversas (por ejemplo, limitación de nutrientes, temperaturas extremas o deshidratación), algunas bacterias producen endosporas, estructuras metabólicamente inactivas que son resistentes al daño físico y químico (1, 2, 8, 9). Las endosporas permiten que la bacteria sobreviva condiciones adversas protegiendo el material genético de las células; una vez que las condiciones son favorables para el crecimiento, las esporas germinan y el crecimiento bacteriano continúa. Las endosporas son difíciles de teñir con técnicas de tinción estándar porque son impermeables a los tintes que normalmente se utilizan para teñir (1, 9). La técnica que se utiliza habitualmente para teñir endosporas es el método de Schaeffer-Fulton (Figura 6), que usa el tinte primario Malachite Green, un tinte soluble en agua que se adhiere relativamente débilmente al material celular y al calor, para permitir que el tinte atraviese la corteza de la espora (Figura 7) . Estos pasos colorean las células en crecimiento (denominadas células vegetativas en el contexto de la biología de las endosporas), así como las endosporas y las esporas libres (aquellas que ya no están dentro de la envoltura celular anterior). Las células vegetativas se lavan con agua para eliminar el verde malaquita; las endosporas retienen la mancha debido al calentamiento del verde malaquita dentro de la espora. Finalmente, las células vegetativas se contratiñen con safranina para visualizar (Figura 8). La tinción de endosporas ayuda a diferenciar las bacterias en formadoras de esporas y no formadoras de esporas, así como también determina si hay esporas presentes en una muestra que, si están presentes, podrían provocar contaminación bacteriana al germinar.
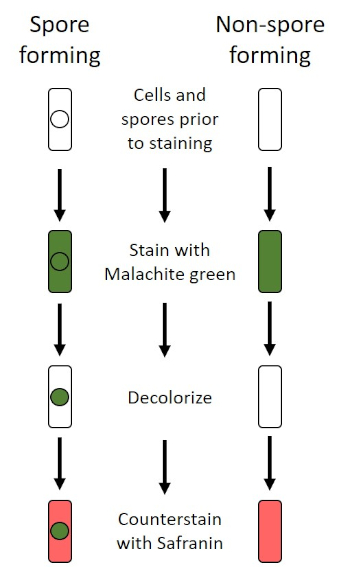
Figura 6: Esquema del protocolo de tinción de endosporas. La columna de la izquierda muestra cómo reaccionan las bacterias formadoras de esporas en cada paso del protocolo. La columna de la derecha muestra cómo reaccionan las bacterias que no forman esporas.
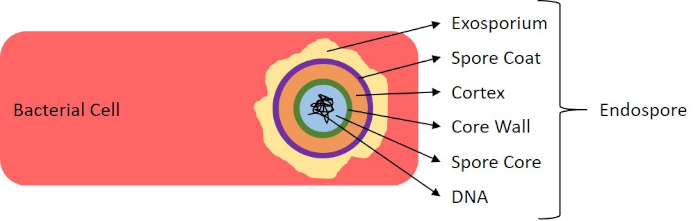
Figura 7: Diagrama de estructura de endosporas. Célula bacteriana que contiene una endospora con las diversas estructuras de esporas marcadas.
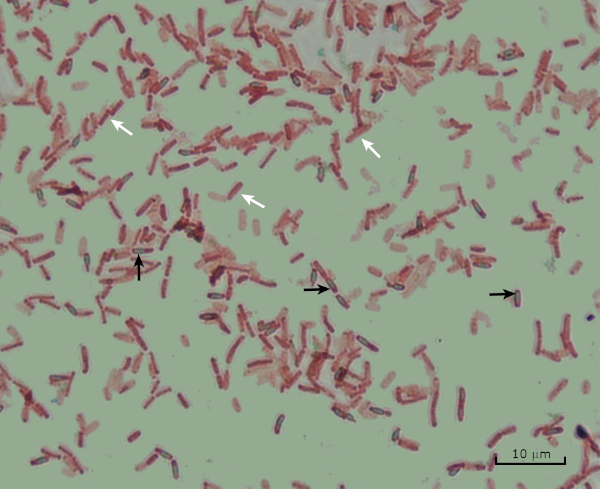
Figura 8: Resultados de la tinción de endosporas. Una tinción típica de endosporas de Bacillus subtilis . Las células vegetativas (indicadas con flechas blancas) se tiñen de rojo, mientras que las endosporas (indicadas con flechas negras) se tiñen de verde.
3. Tinción de endosporas (método de Schaeffer-Fulton)
- Preparar
- Use guantes y una bata de laboratorio no inflamable para proteger las manos y la ropa de los tintes y las llamas.
- Se utiliza un mechero Bunsen para fijar las bacterias con calor. Tenga cuidado al trabajar con llamas; atar el cabello largo.
- Para preparar una solución de verde de malaquita al 0,5%, mezcle 0,125 gramos de verde de malaquita con 25 ml de agua destilada hasta que se disuelva.
- Utilice la solución de reactivo Safranin de Gram disponible en el mercado.
- Limpie los portaobjetos con toallitas de laboratorio.
- Protocolo
- Pipetee 10 µl de solución salina tamponada con fosfato (PBS) o caldo de cultivo en el portaobjetos.
- Utilizando una técnica aséptica, unte una colonia bacteriana en el líquido para producir una capa delgada y uniforme.
Nota: Las endosporas generalmente no se forman en las células jóvenes, por lo que se recomienda que el cultivo tenga entre 18 y 36 horas de edad (9). - Portaobjetos completamente seco al aire.
- Fije con calor pasando el portaobjetos (con las bacterias hacia arriba) a través de la llama 4-5 veces.
- Para ayudar a contener el tinte, coloque un trozo de papel para lentes (cortado para que se ajuste al frotis bacteriano) sobre el frotis fijado con calor.
- Sature el papel para lentes con una solución de verde malaquita.
- Coloque el portaobjetos sobre un vaso de precipitados con agua hirviendo en un plato caliente y cocine al vapor durante 5 minutos, manteniendo húmedo el papel para lentes agregando más tinte gota a gota según sea necesario.
Nota: Evite sobrecalentar y secar la solución de tinte. - Retire el portaobjetos del vaso de precipitados, retire y deseche el papel para lentes, deje que el portaobjetos se enfríe durante 2 minutos.
- Sosteniendo el portaobjetos en un ángulo, enjuague bien rociando un chorro suave e indirecto de agua sobre el portaobjetos, permitiendo que se escurra sobre la mancha.
- Manteniendo el portaobjetos nivelado, empape el frotis con Safranin, deje reposar 1 minuto.
- Enjuague el exceso de safranina como en el paso 3.2.9 anterior.
- Deje secar al aire.
- Examine el portaobjetos en el microscopio bajo inmersión en aceite con un objetivo de 100X.
- Resultados y análisis de datos
- Las esporas se mancharán de verde.
- Las células vegetativas se teñirán de rojo.
- Algunas células vegetativas contendrán esporas; las células se teñirán de rojo, mientras que las endosporas se teñirán de verde.

Comentarios
Publicar un comentario